|
ÍNDICE
|
12. Catabolismo de los ácidos nucleicos 13. Panorámica general del catabolismo 14. El anabolismo 15. Anabolismo autótrofo. Fotosíntesis 1. Pigmentos fotosintéticos. Fotosistemas 16. Fase luminosa 1. Fotofosforilación acíclica 2. Fotofosforilación cíclica 17. Fase oscura 1. Fijación del CO2. Ciclo de Calvin 2. Fotorrespiración 3. Fijación del nitrógeno y el azufre 18. Factores que influyen sobre la fotosíntesis 19. Quimiosíntesis 20. Anabolismo heterótrofo 1. Anabolismo de glúcidos 2. Anabolismo de lípidos 3. Panorámica general del anabolismo hetrótrofo 21. Resumen 22. Actividades de repaso 23. Prácticas 24. Otras presentaciones 25. Cuestiones 26. Vídeos |
2. ESQUEMAS



3. PRESENTACIONES CATABOLISMO





PRESENTACIONES ANABOLISMO





4. EL CATABOLISMO
Entre los distintos tipos de biomoléculas orgánicas que forman parte de las células vivas hay que distinguir por un lado a las proteínas y los ácidos nucleicos, cuya misión fundamental es el almacenamiento, transmisión y expresión de la información genética ("biomoléculas informativas"), y por otro a los glúcidos y lípidos ("biomoléculas energéticas") cuya principal misión es la de proporcionar energía para los distintos procesos celulares y que por lo tanto están llamados a ser los grandes protagonistas del catabolismo.
De todos modos, dado que las células se encuentran en un continuo proceso de renovación de sus componentes moleculares, el catabolismo comprende rutas que permiten llevar a cabo la degradación de todas y cada una de las biomoléculas. En este capítulo analizaremos las distintas rutas catabólicas con especial incidencia en aquellas responsables de la degradación de glúcidos y lípidos, por ser éstas las que más frecuentemente utilizan las células.
5. CATABOLISMO DE AZUCARES
Por ser la glucosa el monosacárido más abundante en la naturaleza, la degradación de los azúcares se lleva a cabo "vía glucosa". Así, el catabolismo de los azúcares converge hacia una única ruta central de degradación de la glucosa.


Una vez transformados en glucosa los azúcares se pueden degradar completamente hasta CO2 Y H2O siguiendo un camino que incluye tres rutas metabólicas principales: Glucolisis, Ciclo de Krebs y Cadena respiratoria. Existe además una ruta alternativa, la Ruta de las pentosas.
6. GLUCOLISIS (RUTA EMBDEN-MEYERHOF)
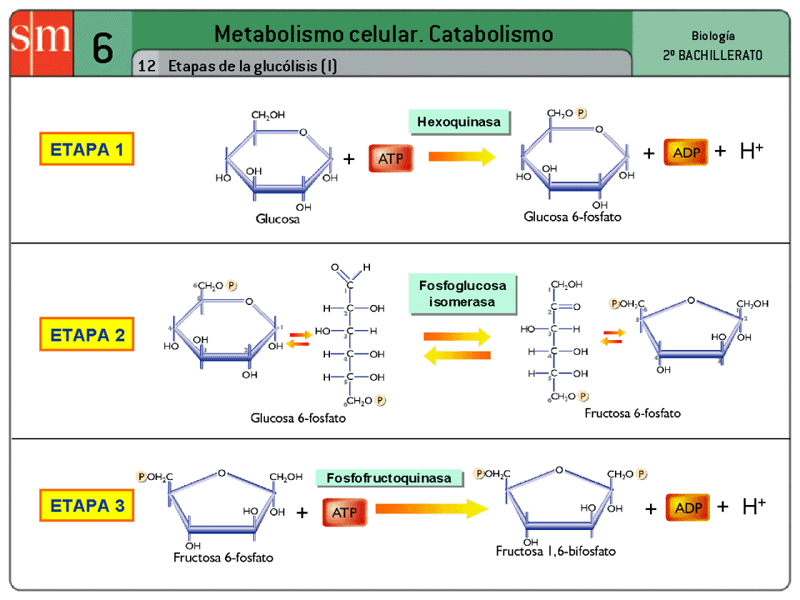
Es un conjunto de 10 reacciones consecutivas que degradan la glucosa (6 átomos de carbono), transformándola en dos moléculas de ácido pirúvico (3 átomos. de C). Estas reacciones son anaerobias, es decir, no participa en ellas el oxígeno, y transcurren íntegramente en el hialoplasma celular. Concomitantemente parte de la energía química de la glucosa es recuperada en forma de ATP y NADH.
Probablemente la glucolisis haya sido, en el curso de la evolución biológica, la primera ruta metabólica de la que las células dispusieron para obtener energía. También fue la primera ruta que los bioquímicos conocieron en su totalidad.
Las 10 etapas de la glucolisis se detallan en el esquema. Podemos agrupar estas 10 reacciones en dos fases bien diferenciadas:
1.- La glucosa se degrada para dar lugar a dos moléculas de gliceraldehido-3-fosfato. Para ello hace falta energía que es aportada por dos moléculas de ATP.
2.- Las dos moléculas de gliceraldehido-3-fosfato se transforman en dos moléculas de ácido pirúvico. La energía liberada en este proceso es recuperada en forma de cuatro moléculas de ATP y dos de NADH. Es fundamentalmente la oxidación del gliceraldehido-3-fosfato en la reacción 6 la que libera la energía química, que se recupera en parte en forma de NADH y en parte, mediante dos fosforilaciones a nivel de sustrato en las reacciones siguientes, en forma de ATP.
Así pues, la glucolisis parece necesitar de una primera fase de "cebado", en la cual se consume energía del ATP, para que la energía química de la glucosa pueda ser liberada en la segunda fase obteniéndose una cantidad mayor de ATP y también NADH.
Haciendo un balance de lo ocurrido durante la glucolisis, por cada molécula de glucosa degradada se obtienen 2 moléculas de ácido pirúvico, 2 moléculas de NADH y 2 moléculas de ATP (4 obtenidas en la segunda fase menos 2 consumidas en la primera).
Sin embargo, algunas formas de vida muy simples, tales como algunas bacterias y levaduras, pueden sobrevivir holgadamente con esta pequeña cantidad de energía que obtienen de la glucolisis, debiendo resolver entonces algunos problemas que analizaremos a continuación.
ANIMACIONES










7. OXIDACIONES RESPIRATORIAS
Las células aerobias pueden oxidar el ácido pirúvico obtenido en la glucolisis en presencia de oxígeno molecular y obtener así una gran cantidad de energía en forma de ATP. El proceso completo de degradación de la glucosa en presencia de oxígeno se conoce como respiración celular.
Desde los tiempos del químico Lavoisier es sabido que el proceso respiratorio consiste en una reacción de la materia orgánica con el oxígeno para dar como productos dióxido de carbono y agua. Esta reacción es similar a la que se produce en la combustión de cualquier tipo de materia orgánica. Se suele decir que las oxidaciones respiratorias son combustiones a baja temperatura o "combustiones sin llama". El proceso de oxidación de la materia orgánica en presencia de oxígeno es fuertemente exergónico y parte de la energía química que en él se libera es recuperada en forma de ATP. La ecuación global de la respiración celular puede escribirse como sigue:
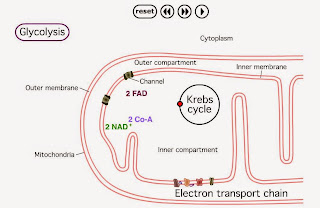
Las reacciones aerobias de la respiración celular tienen lugar íntegramente en la mitocondria, más concretamente en la matriz mitocondrial y en la membrana mitocondrial interna. Veremos más adelante que estas oxidaciones respiratorias no son exclusivas del catabolismo de los azúcares, sino que en gran medida son comunes al catabolismo de otras biomoléculas como lípidos y proteínas. Sin embargo, vamos a centrarnos ahora en los procesos que conducen a la degradación total hasta CO2 y H2O del ácido pirúvico procedente de la glucolisis, a saber, la descarboxilación oxidativa del ácido pirúvico, el ciclo de Krebs, y la cadena respiratoria.
7.1. DESCARBOXILACIÓN OXIDATIVA DEL ÁCIDO PIRÚVICO
El ácido pirúvico procedente de la glucolisis penetra en la matriz mitocondrial a través de permeasas específicas de las membranas mitocondriales. Una vez allí, sufre una descarboxilación oxidativa catalizada por el complejo de la piruvato deshidrogenasa, dando lugar a una molécula de CO2 y a un grupo acetilo del acetil-coenzima A.
Por cada molécula de ácido pirúvico se consume una de coenzima A (un coenzima transportador de grupos acilo) y una molécula de NAD+ es reducida a NADH. Hay que destacar que, dado que cada molécula de glucosa da lugar a dos de ácido pirúvico en la glucolisis, y que en la descarboxilación de cada una de éstas se desprende una molécula de CO2, dos de los seis átomos de carbono de la glucosa se han desprendido ya en forma de estas dos moléculas de CO2, que es uno de los productos finales de la respiración celular.
 7.2. CICLO DE KREBS
7.2. CICLO DE KREBS
El acetil-CoA obtenido en la etapa anterior puede ser ahora oxidado en la misma matriz mitocondrial mediante una ruta metabólica cíclica llamada ciclo de los ácidos tricarboxílicos o ciclo del ácido cítrico, y que, en honor a su descubridor, es más conocida por ciclo de Krebs.
El acetil-CoA obtenido en la etapa anterior puede ser ahora oxidado en la misma matriz mitocondrial mediante una ruta metabólica cíclica llamada ciclo de los ácidos tricarboxílicos o ciclo del ácido cítrico, y que, en honor a su descubridor, es más conocida por ciclo de Krebs.
El ciclo se inicia con la condensación del grupo acetilo del acetil-CoA (2C) con una molécula ácido oxalacético (4C) para dar un ácido tricarboxílico de 6 átomos de carbono, el ácido cítrico. En esta reacción se libera el coenzima A. Posteriormente, en una secuencia de siete reacciones catalizadas enzimáticamente, se eliminan dos átomos de carbono en forma de CO2 y se regenera el ácido oxalacético. Las distintas etapas del ciclo se encuentran detalladas en el esquema.
A lo largo del ciclo se producen dos descarboxilaciones oxidativas, en las etapas 3 y 4, que liberan dos moléculas de CO2. Con ello se completa la degradación del esqueleto carbonado de la glucosa: dos átomos de carbono se desprendieron en forma de dos moléculas de CO2 en la descarboxilación oxidativa de dos moléculas de ácido pirúvico; las dos moléculas de acetil-CoA resultantes ingresan en el ciclo de Krebs liberándose por cada una de ellas otras dos moléculas de CO2; en total se han liberado seis moléculas de CO2 que se corresponden con los seis átomos de carbono de la glucosa.

Por otra parte, las distintas oxidaciones que tienen lugar a lo largo del ciclo liberan electrones, que en unos casos son captados por el NAD+ (reacciones 3, 4 y 8) y en otros por el FAD (reacción 6), los cuales se reducen respectivamente a NADH + H y FADH2.
Además, en la reacción 5, tiene lugar una fosforilación a nivel de sustrato, consecuencia de la anterior oxidación, que da lugar a una molécula de GTP, posteriormente transformable en ATP.
Haciendo un balance de lo ocurrido en el ciclo de Krebs, por cada grupo acetilo del acetil-CoA que ingresa en el mismo se obtienen 2 moléculas de CO2, 3 moléculas de NADH+H, 1 molécula de FADH2 y una molécula de GTP transformable en ATP.
El rendimiento energético en moléculas de ATP obtenido hasta el momento no parece muy alto: sólo dos moléculas de ATP en la glucolisis y otras dos en el ciclo de Krebs (una por cada acetil-CoA). Sin embargo, una gran parte de la energía química de la glucosa está temporalmente retenida en forma de "electrones de alta energía" de los coenzimas reducidos NADH+H y FADH2 que se fueron obteniendo a lo largo de todo el proceso. Será en la siguiente etapa de las oxidaciones respiratorias cuando estos coenzimas cedan sus electrones al oxígeno, produciéndose así, por fin, la liberación de toda esa energía, una parte de la cual será recuperada en forma de ATP.
7.3. CADENA RESPIRATORIA
Los electrones de los coenzimas reducidos NADH y FADH2 procedentes de las anteriores etapas del catabolismo de los azúcares pueden ser ahora cedidos a una de los varios miles de cadenas de transportadores de electrones que se encuentran distribuidas por toda la superficie de la membrana mitocondrial interna y que reciben el nombre de cadenas respiratorias. Estas cadenas conducen los electrones hasta el oxígeno, el aceptor último, que se reduce para formar H2O, el otro producto final de la degradación de la glucosa.
Cada cadena respiratoria está constituida por unas 15 moléculas transportadoras agrupadas en 4 complejos principales. Estos transportadores son proteínas y coenzimas cuya estructura química les permite aceptar o ceder electrones de modo reversible.
El transporte de electrones se realiza mediante una serie de reacciones redox en cada una de las cuales intervienen dos transportadores: uno de ellos se oxida cediendo un par de electrones al otro, que se reduce. Los transportadores no se encuentran distribuidos al azar dentro de la cadena sino que se encuentran ordenados de menor a mayor potencial redox. El potencial redox es una medida de la afinidad que tienen los transportadores por los electrones: la afinidad es mayor cuanto mayor es el potencial redox.
A lo largo del ciclo se producen dos descarboxilaciones oxidativas, en las etapas 3 y 4, que liberan dos moléculas de CO2. Con ello se completa la degradación del esqueleto carbonado de la glucosa: dos átomos de carbono se desprendieron en forma de dos moléculas de CO2 en la descarboxilación oxidativa de dos moléculas de ácido pirúvico; las dos moléculas de acetil-CoA resultantes ingresan en el ciclo de Krebs liberándose por cada una de ellas otras dos moléculas de CO2; en total se han liberado seis moléculas de CO2 que se corresponden con los seis átomos de carbono de la glucosa.
Por otra parte, las distintas oxidaciones que tienen lugar a lo largo del ciclo liberan electrones, que en unos casos son captados por el NAD+ (reacciones 3, 4 y 8) y en otros por el FAD (reacción 6), los cuales se reducen respectivamente a NADH + H y FADH2.
Además, en la reacción 5, tiene lugar una fosforilación a nivel de sustrato, consecuencia de la anterior oxidación, que da lugar a una molécula de GTP, posteriormente transformable en ATP.
Haciendo un balance de lo ocurrido en el ciclo de Krebs, por cada grupo acetilo del acetil-CoA que ingresa en el mismo se obtienen 2 moléculas de CO2, 3 moléculas de NADH+H, 1 molécula de FADH2 y una molécula de GTP transformable en ATP.
El rendimiento energético en moléculas de ATP obtenido hasta el momento no parece muy alto: sólo dos moléculas de ATP en la glucolisis y otras dos en el ciclo de Krebs (una por cada acetil-CoA). Sin embargo, una gran parte de la energía química de la glucosa está temporalmente retenida en forma de "electrones de alta energía" de los coenzimas reducidos NADH+H y FADH2 que se fueron obteniendo a lo largo de todo el proceso. Será en la siguiente etapa de las oxidaciones respiratorias cuando estos coenzimas cedan sus electrones al oxígeno, produciéndose así, por fin, la liberación de toda esa energía, una parte de la cual será recuperada en forma de ATP.
Los electrones de los coenzimas reducidos NADH y FADH2 procedentes de las anteriores etapas del catabolismo de los azúcares pueden ser ahora cedidos a una de los varios miles de cadenas de transportadores de electrones que se encuentran distribuidas por toda la superficie de la membrana mitocondrial interna y que reciben el nombre de cadenas respiratorias. Estas cadenas conducen los electrones hasta el oxígeno, el aceptor último, que se reduce para formar H2O, el otro producto final de la degradación de la glucosa.
Cada cadena respiratoria está constituida por unas 15 moléculas transportadoras agrupadas en 4 complejos principales. Estos transportadores son proteínas y coenzimas cuya estructura química les permite aceptar o ceder electrones de modo reversible.
El transporte de electrones se realiza mediante una serie de reacciones redox en cada una de las cuales intervienen dos transportadores: uno de ellos se oxida cediendo un par de electrones al otro, que se reduce. Los transportadores no se encuentran distribuidos al azar dentro de la cadena sino que se encuentran ordenados de menor a mayor potencial redox. El potencial redox es una medida de la afinidad que tienen los transportadores por los electrones: la afinidad es mayor cuanto mayor es el potencial redox.
La disposición ordenada y fija de los constituyentes de la cadena respiratoria hace que el transporte de electrones se realice a favor de gradiente de potencial redox, es decir, desde buenos dadores de electrones (potencial redox bajo) a buenos aceptores (potencial redox alto). Este transporte a favor de diferencia de potencial redox, que podríamos calificar de "cuesta abajo", es un proceso fuertemente exergónico en el que se desprende una gran cantidad de energía química.
Los electrones procedentes del NADH son cedidos al complejo I, que se encuentra al principio de la cadena, mientras que los que proceden del FADH2 son cedidos al coenzima Q, que se encuentra entre los complejos I y II, por lo que éstos últimos no recorren toda la cadena. En ambos casos son transportados hasta el O2, que de todos los constituyentes de la cadena es el que tiene mayor potencial redox.
Con la llegada de los electrones al oxígeno, que se reduce entonces para formar agua, se completa el proceso de degradación de la glucosa a CO2 y H2O.
7.4. FOSFORILACIÓN OXIDATIVA
En el transporte de electrones a favor de diferencia de potencial redox que se lleva a cabo en la cadena respiratoria se produce un importante desprendimiento de energía. La célula recupera parte de esa energía en forma de ATP mediante un proceso de fosforilación acoplada al transporte electrónico que, en este caso, recibe el nombre de fosforilación oxidativa.
El mecanismo que acopla el transporte electrónico mitocondrial con la fosforilación oxidativa es uno de los ejemplos más patentes de la gran capacidad de las células para manipular eficazmente la energía. Se conoce con el nombre de acoplamiento quimiosmótico de la fosforilación oxidativa.
El átomo de hidrógeno puede disociarse fácilmente dando lugar a un protón y un electrón, y éstos pueden asociarse de nuevo para reconstituir al átomo de hidrógeno. En la cadena respiratoria los electrones pueden viajar en forma de tales electrones o bien, asociados a los correspondientes protones, en forma de átomos de hidrógeno.
Existen transportadores de electrones y transportadores de hidrógeno intercalados a lo largo de toda la cadena. Cuando un transportador de hidrógeno oxida a un transportador de electrones debe captar de su entorno 2 protones para, junto con los dos electrones que acepta, formar dos átomos de hidrógeno.
Cuando por el contrario un transportador de electrones oxida a un transportador de hidrógeno acepta de éste sólo los dos electrones y libera los dos protones que llevan asociados. Este hecho no tendría mayores consecuencias si no fuera porque los transportadores están dispuestos en la membrana mitocondrial interna de manera que cuando un transportador requiere protones los toma siempre del lado de la membrana que da a la matriz, mientras que cuando un transportador libera protones lo hace siempre del lado de la membrana que da al espacio intermembrana.
El resultado de todo ello es que, a medida que los electrones circulan por la cadena respiratoria se produce un bombeo de protones a través de la membrana mitocondrial. Este bombeo genera un gradiente electroquímico de protones entre la matriz y el espacio intermembrana: la concentración de protones se va haciendo mayor en el espacio intermembrana y menor en la matriz. De este modo, el acoplamiento entre un proceso químico, el transporte de electrones, y otro osmótico, el bombeo de protones, se utiliza para recuperar la energía desprendida en el primero de ellos en forma de un gradiente electroquímico "rico en energía".
A lo largo de la cadena respiratoria existen tres centros de bombeo de protones, de manera que por cada par de electrones procedentes del NADH que recorre la cadena se bombean 6 protones (2 en cada centro de bombeo) desde la matriz al espacio intermembrana. Los electrones procedentes del FADH2, al entrar en la cadena en un punto intermedio de ésta, eluden el primer centro de bombeo, con lo que cada par de electrones procedentes de este coenzima bombea sólo 4 protones.
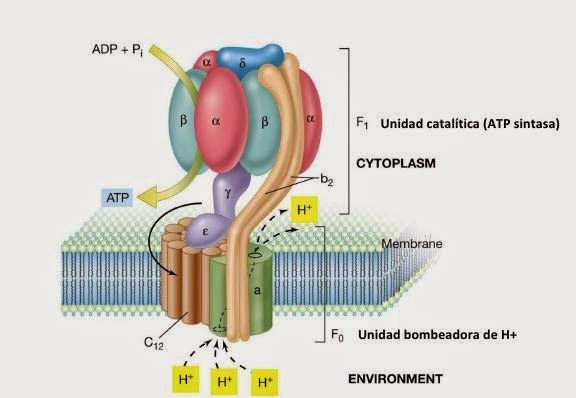
La energía acumulada en forma de gradiente electroquimico de protones se utiliza a continuación para impulsar un proceso endergónico que es la fosforilación de ADP a ATP. Esta reacción es catalizada por un enzima, la ATP-sintetasa, ubicada en la membrana mitocondrial interna. Los protones acumulados en el espacio intermembrana tienden a regresar a la matriz atravesando la membrana a favor de gradiente electroquímico, pero la membrana es relativamente impermeable al paso de los iones, por lo que este regreso sólo puede realizarse a través de la ATP-sintetasa. Es precisamente el regreso de los protones a favor de gradiente electroquímico a través de la ATP-sintetasa lo que libera la energía necesaria para impulsar la fosforilación del ADP a ATP.
Se ha comprobado que el regreso a la matriz de dos protones a través de la ATP-sintetasa libera energía suficiente para obtener una molécula de ATP. Por lo tanto, por cada par de electrones que atraviesan la cadena respiratoria procedentes del NADH+ H se obtendrán 3 moléculas de ATP, mientras que por cada par de electrones procedentes del FADH2 se obtendrán sólo 2 moléculas de ATP.
7.5. BALANCE DE LA OXIDACIÓN DE LA GLUCOSA.
Podemos reunir ahora toda la información acerca de las distintas rutas metabólicas implicadas en la degradación total de la glucosa hasta dióxido de carbono y agua y hacer un balance energético de la misma, es decir, averiguar cuántas moléculas de ATP se han obtenido y qué porcentaje de la energía química de la glucosa ha sido recuperada en forma de enlaces fosfato de alta energía. Un sencillo cálculo (que puedes realizar como ejercicio) nos indica que se obtienen 36 moléculas de ATP por cada molécula de glucosa degradada completamente hasta CO2 y H2O, lo que supone que aproximadamente un 40% de la energía química de la glucosa se ha recuperado en forma de ATP. El resto se ha desprendido en forma de calor y constituye el precio que deben pagar las células por mantenerse alejadas del equilibrio termodinámico.
A lo largo de la cadena respiratoria existen tres centros de bombeo de protones, de manera que por cada par de electrones procedentes del NADH que recorre la cadena se bombean 6 protones (2 en cada centro de bombeo) desde la matriz al espacio intermembrana. Los electrones procedentes del FADH2, al entrar en la cadena en un punto intermedio de ésta, eluden el primer centro de bombeo, con lo que cada par de electrones procedentes de este coenzima bombea sólo 4 protones.
Se ha comprobado que el regreso a la matriz de dos protones a través de la ATP-sintetasa libera energía suficiente para obtener una molécula de ATP. Por lo tanto, por cada par de electrones que atraviesan la cadena respiratoria procedentes del NADH+ H se obtendrán 3 moléculas de ATP, mientras que por cada par de electrones procedentes del FADH2 se obtendrán sólo 2 moléculas de ATP.
7.5. BALANCE DE LA OXIDACIÓN DE LA GLUCOSA.
Podemos reunir ahora toda la información acerca de las distintas rutas metabólicas implicadas en la degradación total de la glucosa hasta dióxido de carbono y agua y hacer un balance energético de la misma, es decir, averiguar cuántas moléculas de ATP se han obtenido y qué porcentaje de la energía química de la glucosa ha sido recuperada en forma de enlaces fosfato de alta energía. Un sencillo cálculo (que puedes realizar como ejercicio) nos indica que se obtienen 36 moléculas de ATP por cada molécula de glucosa degradada completamente hasta CO2 y H2O, lo que supone que aproximadamente un 40% de la energía química de la glucosa se ha recuperado en forma de ATP. El resto se ha desprendido en forma de calor y constituye el precio que deben pagar las células por mantenerse alejadas del equilibrio termodinámico.
2 moleculas de ATP menos porque el NADH+H del citosol al pasar a la matriz mitocondrial genera sólo dos moléculas de ATP.
Por cada molécula de glucosa que se degrada en la glucolisis 2 moléculas de NAD2+ se transforman en NADH+H. Puesto que la cantidad de NAD2+ que poseen las células es limitada debe existir algún mecanismo que permita oxidar el NADH+H transformándolo de nuevo en NAD2+ para que pueda ser reutilizado en la glucolisis, de lo contrario todo el proceso se detendría.
En las células aerobias el NADH+H se oxida a NAD2+ cediendo sus electrones al oxígeno (aceptor último de electrones en este tipo de células) a través de la cadena de transporte electrónico mitocondrial.
En las células anaerobias o, en ocasionesanaerobias facultativas, que no pueden utilizar el oxígeno como aceptor último de electrones en sus oxidaciones metabólicas, el NADH+H se oxida a NAD2+ cediendo sus electrones a una molécula orgánica aceptora, que puede ser el ácido pirúvico o algún producto de la transformación de éste, a través de una o más reacciones adicionales a la glucolisis. Estas etapas adicionales que tienen como único objeto reciclar el NADH+H obtenido en la glucolisis a NAD2+ reciben el nombre defermentaciones.
Las fermentaciones consisten, pues, en la transformación del ácido pirúvico que se obtiene al final de la glucolisis, en algún otro producto orgánico sencillo que es diferente en cada tipo de fermentación. Existen muchos tipos de fermentación que dan lugar a toda una gama de productos, algunos de ellos de interés alimentario o industrial, pero los dos tipos principales son la fermentación homoláctica y la fermentación alcohólica.
8.1. Fermentación homoláctica. Tiene lugar en una sola etapa: el ácido pirúvico acepta un par de electrones procedente del NADH con lo cual se reduce a ácido láctico, que es el producto final.
8.2. Fermentación alcohólica. Tiene lugar en dos etapas. En la primera el ácido pirúvico pierde su grupo carboxilo en forma de CO2 para dar acetaldehido. En la segunda el acetaldehido acepta un par de electrones procedentes del NADH transformándose en alcohol etílico. Alcohol etílico y CO2 son los productos finales.
La fermentación heteroláctica es un tipo mixto en el que se obtiene una molécula de ácido láctico, una de alcohol etílico y una de CO2.
Existen células, llamadas anaerobias estrictas, que en ningún caso pueden utilizar el oxígeno como aceptor de electrones. En ellas la glucolisis, complementada por algún tipo de fermentación, es la única ruta disponible para la obtención de energía. Dado que cuando la vida se originó sobre la Tierra la atmósfera carecía de oxígeno, es de suponer que las primeras células vivas pertenecían a esta categoría.
ANIMACIONES

9. RUTA DE LAS PENTOSAS (RUTA DEL FOSFOGLUCONATO)
La glucolisis tiene como misión recuperar parte de la energía química de la glucosa en forma de ATP. Sin embargo, las células pueden necesitar en ocasiones degradar la glucosa con otros fines.
La ruta de las pentosas es una vía alternativa a la glucolisis que tiene como finalidad la obtención de azúcares de 5 átomos de carbono, como la ribosa, necesarios para la biosíntesis de nucleótidos, y de coenzimas reducidas como el NADPH+H necesario para diversos tipos de biosíntesis en el anabolismo (particularmente para la biosíntesis reductora de ácidos grasos).
En la ruta de las pentosas, la glucosa-6-fosfato da lugar, mediante dos deshidrogenaciones y una descarboxilación en las que se obtiene NADPH+H, a una molécula de CO2 y a un azúcar de 5 átomos de carbono, la ribulosa-5-fosfato, que después se transforma en ribosa-5-fosfato.
Dado que los productos de esta ruta se emplean en procesos biosintéticos del anabolismo, podemos considerar que la ruta de las pentosas es una ruta típicamente anfibólica.
10. CATABOLISMO DE LÍPIDOS
Dado que los lípidos que con más frecuencia degradan las células para obtener energía son los triacilglicéridos o grasas neutras, analizaremos sus rutas degradativas como modelo del catabolismo de los lípidos en general. Recordaremos que los triacilglicéridos son ésteres de la glicerina con tres ácidos grasos.
La primera etapa de la degradación de los triacilglicéridos consiste en la hidrólisis de los tres enlaces éster que poseen para dar lugar a la glicerina y los ácidos grasos libres. Esta reacción de hidrólisis está catalizada por unos enzimas llamados lipasas y tiene lugar en el hialoplasma celular. A continuación la glicerina y los ácidos grasos siguen rutas degradativas separadas.
La glicerina procedente de la hidrólisis de las grasas se fosforila a expensas de una molécula de ATP para dar lugar a glicerol-fosfato, el cual se oxida a continuación, cediendo sus electrones al NAD2+ para transformarse en dihidroxiacetona-fosfato. Este último compuesto se degrada a través de la glucolisis, de la que es uno de sus intermediarios. Así, vemos que la ruta de degradación de la glicerina converge con las rutas del catabolismo de los azúcares. Por otra parte, el NADH+H obtenido así en el hialoplasma, cede sus electrones a los sistemas de lanzadera que los conducirán a la cadena de transporte electrónico mitocondrial para producir ATP.
10.2. ACTIVACIÓN DEL ÁCIDO GRASO
Los ácidos grasos, una vez liberados en el hialoplasma, penetran en la matriz mitocondrial y son allí degradados a acetil-CoA mediante una ruta catabólica llamada ß-oxidación de los ácidos grasos o hélice de Lynen.
Para ello deben ser previamente activados por una molécula de coenzima A transformándose en acil(graso)-CoA. Esta activación tiene lugar cuando el ácido graso atraviesa la membrana mitocondrial externa y requiere el consumo de una molécula de ATP que se hidroliza para dar AMP y pirofosfato. El pirofosfato se hidroliza seguidamente para dar dos moléculas de fosfato inorgánico, con lo que, en realidad, se consumen dos enlaces fosfato de elevada energía.
La ß-oxidación consiste en una secuencia de cuatro reacciones, dos de las cuales son oxidaciones que afectan al carbono de la posición ß del ácido graso. Los electrones liberados en estas dos oxidaciones son recuperados en forma de una molécula de NADH+H y otra de FADH2.
La consecuencia última de estas oxidaciones es la rotura del enlace que une los carbonos α y ß del ácido graso, lo que conlleva la liberación de los dos átomos de carbono terminales en forma de acetil-CoA. Al mismo tiempo, el carbono ß, ahora oxidado a grupo carboxilo, se une a una nueva molécula de CoA, esta vez sin consumo de ATP, dando lugar a un nuevo ácido graso activado con 2 átomos de carbono menos que el original.
Este ácido graso activado puede entrar ahora en un nuevo ciclo de oxidaciones en su carbono ß (otra "vuelta" de la hélice de Lynen), y así sucesivamente hasta la total degradación a acetil-CoA del ácido graso original.
A partir de este momento las rutas degradativas de los ácidos grasos convergen con las de los azúcares: el acetil-CoA obtenido en la ß-oxidación es degradado mediante el Ciclo de Krebs y los coenzimas reducidos que se obtienen en ambas rutas ceden sus electrones a la cadena respiratoria que los conduce hasta el oxígeno para formar agua; en el proceso se desprende energía que es recuperada en forma de ATP en la fosforilación oxidativa.
El balance energético de un ácido graso de 16 carbonos es:
Por lo general las células no utilizan las proteínas como combustible metabólico más que en casos de extrema necesidad. Sin embargo, las células están renovando constantemente sus proteínas. Como parte de este proceso de renovación las proteínas son degradadas a aminoácidos por acción de unos enzimas llamados proteasas. Muchos aminoácidos resultantes de esta degradación son reutilizados para la síntesis de nuevas proteínas; otros, que en un momento dado pueden resultar sobrantes, deben a su vez ser degradados, ya que, a diferencia de lo que ocurre con azúcares y lípidos, no pueden ser almacenados en forma de sustancias de reserva.
La degradación de los aminoácidos se realiza en dos fases sucesivas: la separación de los grupos amino y la degradación de los esqueletos carbonados.
11.1. SEPARACIÓN DE LOS GRUPOS AMINO
Tiene lugar en el hialoplasma y transcurre a su vez en dos fases :
- Transaminación. Los grupos amino de los diferentes aminoácidos son cedidos, mediante reacciones de transaminación catalizadas por las transaminasas, a un cetoácido, el ácido α-cetoglutárico, que se transforma entonces en ácido glutámico. El ácido glutámico funciona como una especie de colector de grupos amino. Lo que queda de un aminoácido tras ceder su grupo amino en la transaminación es lo que llamamos su esqueleto carbonado.
- Desaminación oxidativa. El ácido glutámico obtenido en la fase de transaminación sufre la pérdida de su grupo amino en forma de amoníaco y se recupera el ácido α-cetoglutárico. El proceso implica una oxidación que da lugar a NADH+H o NADPH+H.
Los esqueletos carbonados de muchos aminoácidos coinciden con diversos intermediarios del ciclo de Krebs o rutas colindantes (ácido pirúvico, acetil-CoA, ácido cetoglutárico, ácido succínico, etc.), por lo tanto pueden penetrar en la matriz mitocondrial y ser degradados siguiendo estas rutas metabólicas centrales.
Al igual que sucedía con las proteínas, los ácidos nucleicos no son habitualmente utilizados como combustible metabólico. Los nucleótidos que resultan de la hidrólisis de los ácidos nucleicos por acción de las nucleasas son generalmente reciclados hacia la síntesis de nuevos ácidos nucleicos. Sin embargo, en caso de que existan nucleótidos sobrantes, éstos pueden ser degradados a sus componentes moleculares (pentosas, ácido fosfórico y bases nitrogenadas), los cuales a su vez pueden ser degradados de la siguiente manera:
a) Pentosas.- mediante la ruta de las pentosas fosfato.
b) Ácido fosfórico.- se excreta como tal por la orina
c) Bases nitrogenadas.- se degradan siguiendo complejas rutas que dan lugar a urea, amoníaco y ácido úrico.
13. PANORÁMICA GENERAL DEL CATABOLISMO
El análisis pormenorizado que hemos realizado acerca de las diferentes rutas catabólicas que conducen a la degradación de los diferentes tipos de biomoléculas no debe hacernos perder la perspectiva del catabolismo como una actividad altamente integrada, en la que dichas rutas convergen en su tramo final para dar lugar a unos pocos productos de deshecho (CO2, agua, amoníaco), compartiendo todas ellas el objetivo común de recuperar una parte de la energía química de las biomoléculas degradadas en forma de ATP. Una idea de conjunto acerca del funcionamiento integrado de las distintas rutas catabólicas, junto con las correspondientes rutas anabólicas, se podrá obtener de una inspección detenida de la Figura 16.13.
ACTIVIDADES
14. EL ANABOLISMO
El anabolismo es la fase del metabolismo en la que a partir de unos pocos precursores sencillos y relativamente oxidados se obtienen moléculas orgánicas cada vez más complejas y reducidas.
- Anabolismo autótrofo. Consiste en la síntesis de moléculas orgánicas sencillas a partir de precursores inorgánicos tales como el CO2, el H2O y el NH3. Solamente pueden realizarlo las células autótrofas. Existen dos modalidades de anabolismo autótrofo: la fotosíntesis, que utiliza la energía de la luz (en las células fotolitótrofas), y la quimiosíntesis, que utiliza la energía liberada en reacciones redox (el las células quimiolitótrofas).
- Anabolismo heterótrofo. Consiste en la síntesis de moléculas orgánicas progresivamente más complejas a partir de moléculas orgánicas más sencillas. Todas las células pueden llevarlo a cabo (también las autótrofas). Utiliza la energía del ATP y coenzimas reducidos que se obtienen en el catabolismo.
15. ANABOLISMO AUTÓTROFO: FOTOSÍNTESIS
La fotosíntesis es un proceso que llevan a cabo las células fotolitótrofas en el que, utilizando la energía luminosa capturada por ciertos pigmentos, se sintetiza materia orgánica a partir de materia inorgánica. Su ecuación global puede escribirse como sigue:
La fotosíntesis tiene lugar principalmente en los cloroplastos, siendo la principal función que desempeña este orgánulo en las células de las plantas verdes y de las algas. Sin embargo, algunas células procariotas (como ciertas bacterias y las algas cianofíceas) también realizan la fotosíntesis a pesar de no poseer estos orgánulos, ya que poseen pigmentos fotosintéticos asociados a sus respectivas membranas plasmáticas.
Las reacciones de la fotosíntesis pueden agruparse en dos grandes bloques:
- La fase luminosa, en la que la energía de la luz capturada por los pigmentos fotosintéticos se transforma en energía química del ATP y NADPH+H
- La fase oscura, en la que la energía acumulada en estos dos compuestos es utilizada para transformar el dióxido de carbono y las sales minerales en materia orgánica.
Vamos a considerar en primer lugar la naturaleza y localización de los pigmentos encargados de capturar la energía luminosa, y a continuación analizaremos en detalle las dos fases de la fotosíntesis.
15.1. PIGMENTOS FOTOSINTÉTICOS. FOTOSISTEMAS
La membrana tilacoidal de los cloroplastos, además de los lípidos y las proteínas característicos de toda membrana, posee un 12% de otras sustancias que se denominan, debido a su capacidad para absorber luz, pigmentos fotosintéticos.
15.1. PIGMENTOS FOTOSINTÉTICOS. FOTOSISTEMAS
La membrana tilacoidal de los cloroplastos, además de los lípidos y las proteínas característicos de toda membrana, posee un 12% de otras sustancias que se denominan, debido a su capacidad para absorber luz, pigmentos fotosintéticos.
Existen dos tipos principales de pigmentos: las clorofilas y los carotenoides. Ambos tienen en común el poseer un sistema de dobles enlaces conjugados (dobles enlaces que se alternan con enlaces sencillos). Esta circunstancia es la que les permite absorber la energía luminosa, ya que los electrones de éste sistema de dobles enlaces conjugados pueden "excitarse", es decir, pasar a niveles energéticos superiores, sin que la molécula se rompa. Los distintos tipos de pigmentos están especializados en absorber luz de una determinada longitud de onda, por lo que, actuando de modo coordinado, cubren todo el espectro de la luz visible.

Los pigmentos fotosintéticos no están distribuidos al azar por la membrana tilacoidal sino que están organizados formando fotosistemas. Un fotosistema es una unidad funcional constituida por:


Los pigmentos fotosintéticos no están distribuidos al azar por la membrana tilacoidal sino que están organizados formando fotosistemas. Un fotosistema es una unidad funcional constituida por:
- Un complejo antena. Está formado por varios centenares de moléculas de clorofilas, carotenoides y también proteínas, que absorben la energía de la luz de diferentes longitudes de onda y la canalizan hacia una única molécula de clorofila denominada clorofila diana. La antena funciona como una especie de embudo para capturar la energía luminosa
- Un centro de reacción. Está formado por la clorofila diana, un dador de electrones y un aceptor de electrones que pueden variar de unos fotosistemas a otros.


Las reacciones de la fase luminosa guardan cierto parecido con las de la última fase de la respiración celular. También consisten en un transporte de electrones a través de una cadena de transportadores que, en este caso, está ubicada en la membrana tilacoidal de los cloroplastos. Sin embargo existe una diferencia importante: mientras que en la mitocondria el transporte electrónico se realizaba a favor de gradiente de potencial redox, es decir, desde buenos dadores de electrones a buenos aceptores, en el cloroplasto este transporte se realiza en sentido contrario, desde el H2O, que es un débil dador de electrones, hasta el NADP2+, que es un débil aceptor. Este transporte electrónico "cuesta arriba" es un proceso endergónico, y no tendría lugar si no se le suministra energía. Aquí es donde interviene la energía luminosa captada por los pigmentos fotosintéticos: es utilizada para impulsar los electrones desde el agua hasta el NADP2+, que se reduce entonces para dar NADPH+H.
El proceso comienza cuando la luz excita un par de electrones del PS II, que se oxida, y puede aceptar ahora otros dos electrones procedentes del agua volviendo a su estado inicial. Para ello la molécula de agua se rompe (fotolisis del agua) liberando así el oxígeno, que es uno de los productos de la fotosíntesis.
Los electrones excitados del PS II son cedidos a la cadena de transportadores. Al mismo tiempo que esto sucedía, un par de electrones del PS I fueron excitados por la luz y cedidos a otro tramo de la cadena que los conduce al NADP2+ que se reduce a NADPH+H. Los electrones procedentes del PS II son cedidos ahora al PS I que recupera su estado inicial.
Aunque globalmente el transporte electrónico fotosintético se realiza "cuesta arriba", el uso combinado de los dos fotosistemas permite la existencia de un tramo descendente en el que los electrones circulan a favor de gradiente de potencial redox. En este tramo se libera algo de energía que, de modo similar a lo que ocurre en la mitocondria, es utilizada para bombear protones a través de la membrana tilacoidal (desde el estroma al espacio intratilacoide), creando así un gradiente electroquímico de protones. En esta membrana también existe una ATP-sintetasa que, gracias a la energía liberada al regresar los protones al estroma, puede sintetizar ATP. Dado que el tramo descendente al que aludimos es corto comparado con la totalidad de la cadena, se bombean muy pocos protones y sólo se obtienen una molécula de ATP por cada par de electrones que circulan desde el agua al NADP2+. El proceso descrito recibe el nombre de fotofosforilación no cíclica.
Haciendo un balance de lo ocurrido se observa que por cada molécula de agua que se rompe por fotolisis se obtieneuna molécula de NADPH+H y una molécula de ATP. Esto plantea un problema, ya que, como veremos, en la fase oscura se necesita más cantidad de ATP que de NADPH+H. Por ello, las células fotosintéticas se ven obligadas a recurrir a un mecanismo alternativo al que hemos descrito que les permita obtener ATP sin obtener NADPH.
Este mecanismo alternativo recibe el nombre de fotofosforilación cíclica y consiste en lo siguiente: los electrones excitados del PS I, en lugar de ser cedidos al NADP2+, lo son a los transportadores del tramo descendente de la cadena, regresando al PS I; en este regreso se libera energía suficiente para bombear protones y obtener ATP. A diferencia de lo que ocurre en la fotofosforilación no cíclica, no participa el agua, no se libera oxígeno, no participa el PS II y no se obtiene NADPH+H.
Aunque globalmente el transporte electrónico fotosintético se realiza "cuesta arriba", el uso combinado de los dos fotosistemas permite la existencia de un tramo descendente en el que los electrones circulan a favor de gradiente de potencial redox. En este tramo se libera algo de energía que, de modo similar a lo que ocurre en la mitocondria, es utilizada para bombear protones a través de la membrana tilacoidal (desde el estroma al espacio intratilacoide), creando así un gradiente electroquímico de protones. En esta membrana también existe una ATP-sintetasa que, gracias a la energía liberada al regresar los protones al estroma, puede sintetizar ATP. Dado que el tramo descendente al que aludimos es corto comparado con la totalidad de la cadena, se bombean muy pocos protones y sólo se obtienen una molécula de ATP por cada par de electrones que circulan desde el agua al NADP2+. El proceso descrito recibe el nombre de fotofosforilación no cíclica.
Este mecanismo alternativo recibe el nombre de fotofosforilación cíclica y consiste en lo siguiente: los electrones excitados del PS I, en lugar de ser cedidos al NADP2+, lo son a los transportadores del tramo descendente de la cadena, regresando al PS I; en este regreso se libera energía suficiente para bombear protones y obtener ATP. A diferencia de lo que ocurre en la fotofosforilación no cíclica, no participa el agua, no se libera oxígeno, no participa el PS II y no se obtiene NADPH+H.

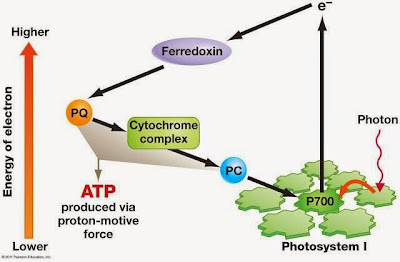
El balance global de la fase luminosa de la fotosíntesis es:
17. FASE OSCURA
Las reacciones de la fase oscura tienen lugar en el estroma y en ellas la energía química del ATP y NADPH obtenidos durante la fase luminosa es utilizada para fijar el CO2 y las sales minerales en forma de materia orgánica. Por lo tanto, aunque estas reacciones pueden transcurrir en ausencia de luz, dependen de los productos de la fase luminosa. Es más, el tiempo durante el que dichas reacciones tienen lugar en la oscuridad es muy limitado, y sólo se prolonga mientras los productos de la fase luminosa no se agotan por completo, por lo que quizás la denominación de "fase oscura" no sea del todo afortunada.
Las reacciones de la fase oscura tienen lugar en el estroma y en ellas la energía química del ATP y NADPH obtenidos durante la fase luminosa es utilizada para fijar el CO2 y las sales minerales en forma de materia orgánica. Por lo tanto, aunque estas reacciones pueden transcurrir en ausencia de luz, dependen de los productos de la fase luminosa. Es más, el tiempo durante el que dichas reacciones tienen lugar en la oscuridad es muy limitado, y sólo se prolonga mientras los productos de la fase luminosa no se agotan por completo, por lo que quizás la denominación de "fase oscura" no sea del todo afortunada.
17.1. FIJACIÓN DEL CO2. CICLO DE CALVIN
La fijación fotosintética del CO2 se lleva a cabo mediante una ruta metabólica cíclica conocida como ciclo de Calvin en honor a su descubridor. Se trata de una ruta muy compleja que pudo haber evolucionado a partir de la ruta de las pentosas. Sin entrar en detalles vamos a resumir los principales acontecimientos que tienen lugar en esta ruta:
El CO2 se fija inicialmente sobre la ribulosa-1,5-difosfato (5C), que es la molécula aceptora, dando lugar a 2 moléculas de ácido fosfoglicérico (3C).
El ácido fosfoglicérico, a expensas del ATP y NADPH+H procedentes de la fase luminosa, se reduce a gliceraldehido-3-fosfato, que está en equilibrio con su isómero, la dihidroxiacetona-fosfato.
Estos dos fosfatos de triosa son utilizados en parte para regenerar la ribulosa-difosfato mediante una serie de reacciones que implican gasto de ATP, y en parte son desviados hacia el anabolismo heterótrofo para servir de precursores a distintos tipos de biomoléculas.
Además este enzima puede utilizar como sustrato al oxígeno en lugar del dióxido de carbono, dando lugar a una secuencia de reacciones que terminan liberando CO2. Este fenómeno se conoce como fotorrespiración y es responsable de una sensible disminución en el rendimiento de la fotosíntesis (la fotosíntesis fija CO2 y la fotorrespiración lo libera).
Algunas plantas tropicales, llamadas plantas C4, evitan este problema fijando inicialmente el CO2 mediante una ruta alternativa al ciclo de Calvin, la ruta de Hatch y Slack, en la que el enzima responsable de la fijación no se ve interferido por el oxígeno.
17.2. FIJACIÓN DEL NITRÓGENO Y EL AZUFRE
Además del carbono, las células fotosintéticas necesitan de otros elementos como el nitrógeno y azufre para poder sintetizar algunas biomoléculas como por ejemplo los aminoácidos. Estos elementos son incorporados en forma de sales minerales, como nitratos y sulfatos, que están presentes en el suelo.
Los nitratos son inicialmente reducidos a nitritos y después a amoníaco, a expensas del poder reductor del NADPH+H obtenido en la fase luminosa. A continuación, el amoníaco es incorporado al esqueleto carbonado del ácido α-cetoglutárico para dar ácido glutámico en una reacción que consume ATP procedente también de la fase luminosa.
17.2. FIJACIÓN DEL NITRÓGENO Y EL AZUFRE
Además del carbono, las células fotosintéticas necesitan de otros elementos como el nitrógeno y azufre para poder sintetizar algunas biomoléculas como por ejemplo los aminoácidos. Estos elementos son incorporados en forma de sales minerales, como nitratos y sulfatos, que están presentes en el suelo.
Los nitratos son inicialmente reducidos a nitritos y después a amoníaco, a expensas del poder reductor del NADPH+H obtenido en la fase luminosa. A continuación, el amoníaco es incorporado al esqueleto carbonado del ácido α-cetoglutárico para dar ácido glutámico en una reacción que consume ATP procedente también de la fase luminosa.
De modo parecido, los sulfatos son reducidos a sulfitos y después a ácido sulfhídrico, que a continuación se incorpora en el esqueleto de algunos aminoácidos como la cisteína.
Hay una serie de factores ambientales que afectan a la intensidad de la fotosíntesis, es decir, al ritmo con el que las células fotosíntéticas fijan la materia inorgánica en forma de materia orgánica. Dado que la fotosíntesis es un proceso que consume CO2 y desprende O2, la intensidad fotosintética puede determinarse experimentalmente midiendo el volumen de CO2 consumido o de O2 desprendido.
Los factores ambientales que afectan a la fotosíntesis son:
- Concentración de CO2 en el medio. Si la iluminación es constante, la intensidad fotosintética aumenta con la concentración de dióxido de carbono en el medio). Esto es debido a que a mayor concentración de CO2 mayor será la velocidad a la que la ribulosa difosfato carboxilasa fijará el CO2 en el ciclo de Calvin.
- Intensidad de la iluminación. En general la intensidad de la iluminación aumenta el rendimiento de la fotosíntesis. Esto es debido a que cuantos más fotones de luz lleguen a los fotosistemas I y II, más cantidad de ATP y NADPH se obtendrán en la fase luminosa y en consecuencia más CO2 se podrá fijar en la fase oscura. Sin embargo, si se sobrepasa un cierto límite de intensidad luminosa puede producirse la desnaturalización de los enzimas que actúan en el proceso con lo que la intensidad fotosintética disminuye bruscamente. Si la concentración de CO2 es muy baja la iluminación apenas influye sobre la intensidad fotosintética (de poco vale que se obtenga mucho ATP yNADPH en la fase luminosa si no hay CO2 para fijar en la fase oscura). Sin embargo, a partir de un cierto valor en la concentración de CO2 la intensidad de iluminación se convierte en un factor limitante para el proceso fotosintético.
- Concentración de oxígeno. El O2tiene un efecto inhibitorio sobre la fotosíntesis: a mayor concentración de O2 en el medio menor es la intensidad fotosintética. Esto es debido al fenómeno de la fotorrespiración.
- Temperatura.-Las reacciones fotoquímicas de la fase luminosa son independientes de la temperatura. Sin embargo, las reacciones de la fase oscura incrementan su velocidad con la temperatura tal como ocurre en cualquier reacción química. Todo ello siempre que no se alcance un valor tal que se provoque la desnaturalización de los enzimas, en cuyo caso la intensidad fotosintética disminuye bruscamente.
19. QUIMIOSÍNTESIS
La quimiosíntesis es un proceso que llevan a cabo las células quimiolitótrofas, las cuales son capaces de utilizar la energía liberada en la oxidación de moléculas inorgánicas sencillas para fijar la materia inorgánica en forma de materia orgánica. Sólo un reducido número de bacterias, entre las que destacan las bacterias del suelo que oxidan el amoníaco a nitritos y estos a nitratos, pueden llevar a cabo este proceso.
La quimiosíntesis, de manera análoga a la fotosíntesis consta de dos fases:
- En la primera fase, análoga a la fase luminosa de la fotosíntesis, se obtiene energía química en forma de ATP y coenzimas reducidos a partir de la oxidación de compuestos inorgánicos sencillos tales como amoníaco, nitritos, azufre y sus derivados, hierro y otros. Cada grupo de organismos quimiosintéticos está especializado en la obtención de energía a partir de un determinado tipo de compuestos inorgánicos.
- En la segunda, el ATP y coenzimas reducidos obtenidos en la fase anterior son utilizados para reducir compuestos inorgánicos transformándolos en compuestos orgánicos. Esta segunda fase es muy similar, tanto para el carbono como para el nitrógeno, a la fase oscura de la fotosíntesis.


20. ANABOLISMO HETERÓTROFO
Las rutas del anabolismo heterótrofo son comunes para todas las células. En ellas se sintetizan macromoléculas fuertemente reducidas a partir de moléculas orgánicas relativamente oxidadas.
Las células autótrofas obtienen estas moléculas precursoras fabricándolas en el anabolismo autótrofo, mientras que las células heterótrofas las obtienen a partir del catabolismo de distintos tipos de biomoléculas ingeridos en el alimento.
El anabolismo heterótrofo es un proceso endergónico y como tal consume energía química que es aportada por elATP y coenzimas reducidos. La mayoría de las reacciones del anabolismo heterótrofo tienen lugar en el hialoplasma de la célula; algunas finalizan en el retículo endoplasmático o en el aparato de Golgi.
Muchas rutas del anabolismo heterótrofo recorren en parte el camino inverso de las correspondientes rutas catabólicas aprovechando aquellas reacciones que son claramente reversibles. Las reacciones irreversibles se evitan dando "rodeos metabólicos".
A continuación haremos un breve resumen de las principales rutas del anabolismo heterótrofo:
20.1. Anabolismo de glúcidos.
Se realiza en dos fases sucesivas: la síntesis de la glucosa y la síntesis de polisacáridos. La síntesis de la glucosa se realiza a partir del ácido pirúvico en una ruta denominada gluconeogénesis. Esta ruta recorre en gran parte el camino de la glucolisis en sentido ascendente. Cuando en este camino se encuentra una reacción irreversible se evita mediante una secuencia alternativa que consta de varias reacciones. En las células autótrofas los fosfatos de triosa obtenidos en el ciclo de Calvin se incorporan a la gluconeogénesis, de la cual son intermediarios, sirviendo así de nexo entre el anabolismo autótrofo y el heterótrofo. La síntesis de polisacáridos se lleva a cabo a partir de glucosa fosforilada en un proceso enzimático que consume energía del UTP o del ATP. Para fabricar una molécula de glucosa a partir de 2 moléculas de ácido pirúvico se necesitan 6 moleéculas de ATP y dos moléculas de NADPH+H.
Para incorporar la molécula de glucosa a la cedena de glucógeno o almidón en crecimiento se consumen 2 moléculas de ATP en la ruta de la glucogenogénesis.


20.2. Anabolismo de lípidos
La síntesis de triacilglicéridos requiere glicerina y ácidos grasos. La glicerina, en forma de glicerol-fosfato, se obtiene por reducción de la dihidroxiacetona, o bien se recicla la que procede de la hidrólisis de otros lípidos. Los ácidos grasos se sintetizan a partir de acetil-CoA en un proceso catalizado por varios enzimas que forman el complejo de la ácido graso sintetasa. La síntesis de ácidos grasos requiere gran cantidad de poder reductor, que es aportado por el NADPH+H.
En vista de lo anterior, se entiende la siguiente estequeometría:
En vista de lo anterior, se entiende la siguiente estequeometría:
8 Acetil-CoA + 14 (NADPH + H+) + 7 ATP → Ácido palmítico (C16) + 8 CoA + 14 NADP+ + 7 (ADP + Pi) + 6 H2O
Dado que el Á.palmítico tiene 16 carbonos, se requieren 7 ciclos (de 4 carbonos el primero y 2 los siguientes) para formarlo. Por ello se necesitan:c) Anabolismo de proteínas.- La síntesis de aminoácidos se realiza mediante reacciones de transaminación, inversas a las que tienen lugar en la degradación de los mismos, en las que el grupo amino del ácido glutámico es transferido a diversos esqueletos carbonados presentes en la célula, los cuales proceden del ciclo de Krebs o de otras rutas afines. El ensamblaje de los aminoácidos para formar proteína se lleva a cabo en los ribosomas siguiendo las instrucciones cifradas en la secuencia de nucleótidos del DNA.
d) Anabolismo de ácidos nucleicos.- Aunque los nucleótidos, o sus componentes moleculares, que proceden de la hidrólisis de unos ácidos nucleicos generalmente se reciclan para sintetizar otros, a veces puede ser necesario sintetizarlos "ex novo". La ribosa y la desoxirribosa se obtienen en la ruta de las pentosas. El ácido fosfórico es un componente habitual de las células. Las base nitrogenadas se sintetizan mediante complejas secuencias de reacciones que parten de los esqueletos de diversos aminoácidos.
20.3. PANORÁMICA GENERAL DEL ANABOLISMO HETERÓTROFO
Al igual que sucedía con el catabolismo, es conveniente adquirir una perspectiva global del anabolismo, tratando de entender que se trata de una actividad química que las células realizan con el objetivo de construir diferentes tipos de biomoléculas reducidas a partir de unos pocos precursores relativamente oxidados. Para ello será necesario utilizar energía procedente del ATP y de los coenzimas reducidos que las células autótrofas obtienen en la fase luminosa de la fotosíntesis y las células heterótrofas mediante el catabolismo de otras biomoléculas.
Dado que el Á.palmítico tiene 16 carbonos, se requieren 7 ciclos (de 4 carbonos el primero y 2 los siguientes) para formarlo. Por ello se necesitan:c) Anabolismo de proteínas.- La síntesis de aminoácidos se realiza mediante reacciones de transaminación, inversas a las que tienen lugar en la degradación de los mismos, en las que el grupo amino del ácido glutámico es transferido a diversos esqueletos carbonados presentes en la célula, los cuales proceden del ciclo de Krebs o de otras rutas afines. El ensamblaje de los aminoácidos para formar proteína se lleva a cabo en los ribosomas siguiendo las instrucciones cifradas en la secuencia de nucleótidos del DNA.
d) Anabolismo de ácidos nucleicos.- Aunque los nucleótidos, o sus componentes moleculares, que proceden de la hidrólisis de unos ácidos nucleicos generalmente se reciclan para sintetizar otros, a veces puede ser necesario sintetizarlos "ex novo". La ribosa y la desoxirribosa se obtienen en la ruta de las pentosas. El ácido fosfórico es un componente habitual de las células. Las base nitrogenadas se sintetizan mediante complejas secuencias de reacciones que parten de los esqueletos de diversos aminoácidos.
20.3. PANORÁMICA GENERAL DEL ANABOLISMO HETERÓTROFO
Al igual que sucedía con el catabolismo, es conveniente adquirir una perspectiva global del anabolismo, tratando de entender que se trata de una actividad química que las células realizan con el objetivo de construir diferentes tipos de biomoléculas reducidas a partir de unos pocos precursores relativamente oxidados. Para ello será necesario utilizar energía procedente del ATP y de los coenzimas reducidos que las células autótrofas obtienen en la fase luminosa de la fotosíntesis y las células heterótrofas mediante el catabolismo de otras biomoléculas.
ACTIVIDADES
21. RESUMEN
22. ACTIVIDADES DE REPASO





23. PRÁCTICAS
Catalasa y desnaturalización. Guión
Fermentación alcohólica. Guión
Fermentación láctica. Guión
Actividad de la catalasa
Catalasa
Catalasa y desnaturalización
Desnaturalización de la catalasa
Catalasa 2
Comprobar que se desprende CO2
Prácticas laboratorio
24. OTRAS PRESENTACIONES
Fotosíntesis 1
Biosíntesis de glúcidos
Catabolismo
Catabolismo 2
Glicólisi
Ciclo de Krebs
Metabolismo de proteínas
Oxidación de ácidos grasos
Catabolismo
25. CUESTIONES
Preguntas selectividad Valencia. MetabolismoPreguntas selectividad Valencia. Anabolismo. Fotosínteis
Preguntas selectividad Valencia. Catabolismo
Cuestiones selectividad importantes. Metabolismo
Cuestiones selectividad importantes. Catabolismo
Cuestiones selectividad importantes. Anabolismo
Metabolismo. Repiración celularMetabolismo
Fotosíntesis 1
26. VÍDEOS
Tipos de inhibición